Галогенированные липиды, образующиеся в реакциях, катализируемых миелопероксидазой (МПО), могут выполнять роль регуляторов функциональной активности клеток. Мы исследовали влияние хлор- и бромгидринов, полученных в реакциях соответственно HOCl и HOBr с 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолином (РОРС), на три различных функциональных ответа нейтрофилов человека: продукцию Н2О2, дегрануляцию (экзоцитоз МПО) и агрегацию. Показано, что хлор- и бромгидрины РОРС вызывали прайминг нейтрофилов, что проявлялось в заметном усилении ответов клеток на действие таких стимуляторов нейтрофилов, как N-формил-Met-Leu-Phe и лектин Solanum tuberosum. Результаты работы позволяют говорить о галогенированных липидах, образующихся in vivo в МПО-зависимых реакциях, как о новом классе биологически активных веществ, потенциально способных оказывать праймирующее действие на клетки миелоидного происхождения в очагах воспаления, а значит, являющихся важными модуляторами воспалительного ответа [Горудко И.В. с соавт., 2010].
Секреторная фосфолипаза А2 группы IIA (секФлА2-IIA) является активным участником воспаления. Фермент разрушает клеточные стенки бактерий и индуцирует образование биоактивных липидных медиаторов. Галогенированные фосфолипиды (хлор- и бромгидрины) образуются совместно с окисленными фосфолипидами в результате взаимодействия HOCl и HOBr с ненасыщенными связями ацильных цепей. Изучалось влияние хлор- и бромгидринов 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина (POPC) на активность секФлА2-IIA. Хлор- и бромгидрины РОРС (РОРС-Сl и РОРС-Br соответственно) в отличие от РОРС не гидролизовались секФлА2-IIA. Кроме того, фосфолипиды, являющиеся субстратами секФлА2-IIA, не расщеплялись ферментом в присутствии РОРС-Сl и РОРС-Br. В отличие от окисленных фософлипидов, которые стимулируют активность секФлА2-IIA, галогенгидрины РОРС ингибировали как очищенную секФлА2-IIA, так и секФлА2-IIA в сыворотке крови пациентов. Таким образом, галогенированные фосфолипиды, образующиеся in vivo в МПО-зависимых реакциях, представляют собой новый класс биологически активных веществ, потенциально способных регулировать активность секФлА2-IIA в очагах воспаления, а значит, являются важными модуляторами воспалительного ответа [Korotaeva A. et al., 2013].
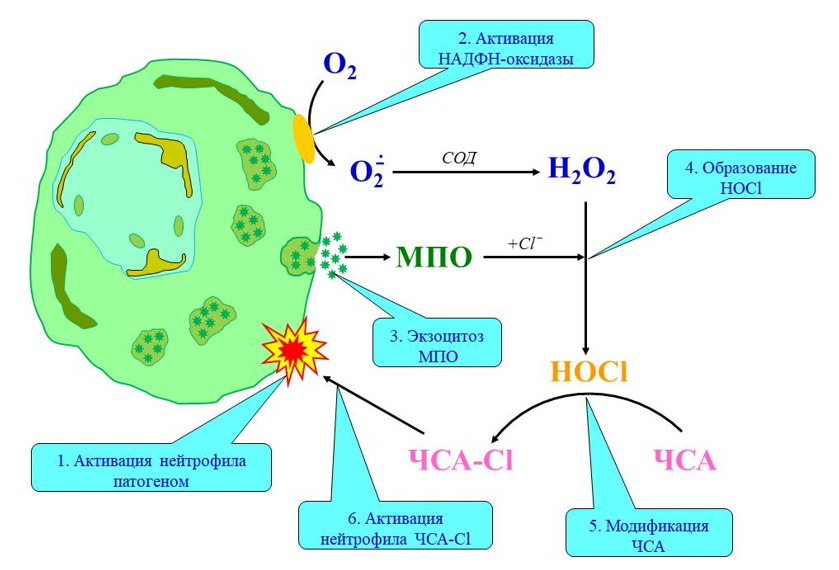
Показано, что альбумин cывоpотки кpови человека (ЧСА), модифициpованный HOCl или HOBr (ЧСА-Cl/Br), индуцирует дегрануляцию азурофильных (выход МПО) и специфических (выход лактоферрина) гранул, активацию НАДФН-оксидазы (продукция Н2О2 и супероксид анион-радикала), изменение формы нейтрофилов и усиливает люминол-зависимую хемилюминесценцию нейтрофилов в ответ на добавление активатора – фоpбол-12-миpиcтат-13-ацетата. Схема, описывающая образование галогенированных белков, а также их участие в активации нейтрофилов представлена ниже на рисунке. Стимуляция нейтрофила в ответ на присутствие патоген-специфических молекулярных паттернов (путь 1) сопровождается активацией мембраносвязанной НАДФН-оксидазы (путь 2) и дегрануляцией азурофильных гранул с частичным экзоцитозом МПО (путь 3). Создаются все условия для протекания ферментативной реакции, в которой образуется HOCl (путь 4). Находящийся в непосредственной близости ЧСА подвергается модификации с образованием ЧСА-Cl (путь 5). Последний, взаимодействуя с поверхностью нейтрофила, активирует клетку (путь 6), замыкая тем самым «порочный круг» активации нейтрофилов в очаге воспаления [Михальчик Е.В. с соавт., 2013].
Кроме того, действие ЧСА-Cl/Br на нейтрофилы сопровождается реорганизацией актинового цитоскелета. ЧСА-Cl/Br-индуцированная активация нейтрофилов (продукция Н2О2 и экзоцитоз МПО) ингибировались в присутствии анти-CD18, антитела к бета-субъединице интегрина бета-2, а также в присутствии генестеина, ингибитора тирозинкиназ, и ворталамина, ингибитора фосфатидилинозитол-3-киназы (PI3K). Таким образом, модифицированный в МПО-зависимых реакциях ЧСА, интегрин-зависимым образом через активацию тирозинкиназ, PI3K и реорганизацию цитоскелета стимулирует эффекторные функции нейтрофилов, действуя по принципу положительной обратной связи и выступая в качестве медиатора воспаления [Gorudko E.V. et al., 2014].
При взаимодействии нейтрофилов с липопротеинами низкой плотности крови человека (ЛНП), модифицированными HOCl или HOBr, достоверно повышался выход МПО – маркера азурофильных гранул, что выявлялось по увеличению вне клетки концентрации и активности этого фермента, но при этом мало изменялось содержание внеклеточного лактоферрина – маркера специфических гранул. Полученные результаты свидетельствуют о том, что обнаруживаемые в очагах воспаления ЛНП, модифицированные в условиях окислительного/галогенирующего стресса, выполняют роль регулятора селективного экзоцитоза МПО [Sokolov A.V. et al. 2014].
Полученные результаты свидетельствуют о том, что обнаруживаемые в очагах воспаления фосфолипиды, белки и липопротеины, модифицированные в условиях окислительного/галогенирующего стресса, выполняют роль регулятора селективного экзоцитоза МПО, усиливая тем самым бактерицидную функцию нейтрофилов по принципу положительной обратной связи или же при неблагоприятных условиях замыкая «порочный круг» цитотоксического эффекта со стороны окислителей, образующихся в реакциях с участием МПО.

