Липопротеины низкой плотности (ЛНП) крови человека, модифицированные в присутствии HOCl, вызывали накопление холестерина в клетках сосудистой стенки, способствуя развитию атеросклероза. HOCl образуется в цикле галогенирования МПО. Методом аффинной хроматографии на МПО-Сефарозе было показано, что МПО связывается с поверхностью ЛНП. Это связывание разобщается при ионной силе раствора выше 0,3 М NaCl или рН ниже 3,6, что свидетельствует в пользу ионной природы взаимодействия МПО с ЛНП. Использование спиновых зондов липидной природы, показало, что взаимодействие с МПО не оказывает существенного влияния на липидные компоненты ЛНП, свидетельствуя об отсутствии их участия в образовании контактов между МПО и ЛНП. В то же время, антитела против апоВ-100 полностью разобщали связывание МПО с поверхностью ЛНП. Среди анионных синтетических пептидов, имитирующих фрагменты апоВ-100 (1EEEMLEN7, 53VELEVPQ59 и 445EQIQDDCTGDED456), МПО из комплекса с ЛНП вытеснил только последний пептид. Таким образом, вероятным сайтом взаимодействия МПО с ЛНП является участок апоВ-100 – 445-456 [Sokolov A.V. et al. 2010; Sokolov A.V. et al. 2011].
Было исследовано влияние пептида 445EQIQDDCTGDED456 (Р445-456), а также ингибиторов и модуляторов галогенирующей активности MПO: церулоплазмина (ЦП), гидразида 4-аминобензойной кислоты (ABAH) и тиоцианата (SCN-), на аккумуляцию моноцитами/макрофагами холестерина и его эфиров после инкубации с ЛНП, подвергнутыми различным вариантам MПO-зависимой окислительной/галогенирующей модификации. На основании полученных данных можно предложить обобщенную схему участия MПO, продуцируемых ею активных форм галогенов, а также разобщителя ее связывания с ЛНП (P445-456) и ингибиторов/модуляторов галогенирующей активности (ABAH, ЦП, SCN-) в проатерогенной модификации ЛНП и формировании пенистых клеток (см. рис.) [Sokolov A.V. et al. 2014].
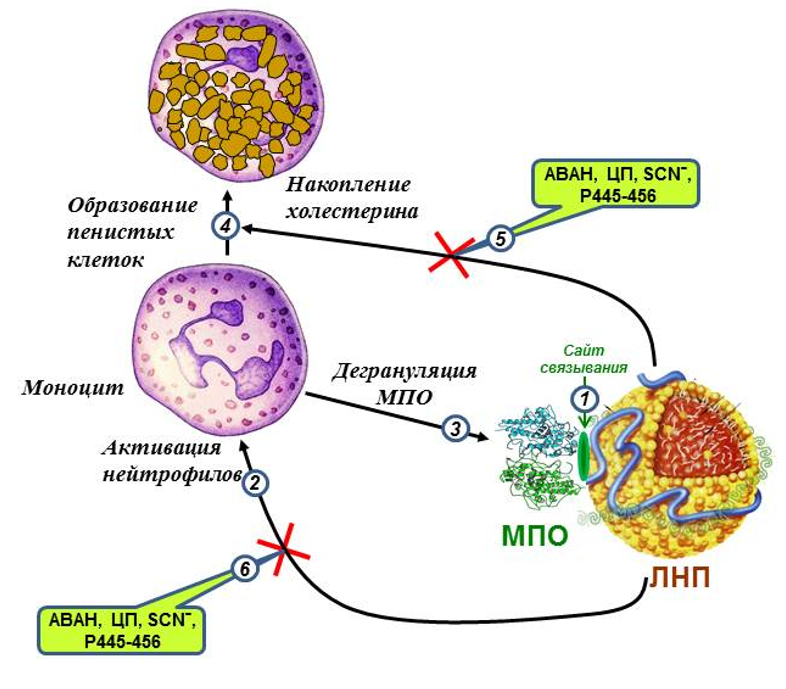 Связывание MПO с ЛНП (1) приводит к их сайт-специфической модификации, заключающейся в повреждении главным образом белка, а также галогенирования/пероксидации липидов под действием активных форм галогенов (HOCl, HOBr), образующихся в ходе функционирования галогенирующего цикла MПO. Модифицированные ЛНП являются стимулом для лейкоцитов (2), провоцируя респираторный взрыв и экзоцитоз МПО (3) нейтрофилами и моноцитами (на рис. указано в случае моноцитов). Секретируемая MПO связывается с ЛНП (1), и, используя в качестве субстрата продуцируемый лейкоцитами Н2О2, усиливает их повреждение, замыкая тем самым «порочный круг» образования модифицированных ЛНП (1-3). Модифицированные ЛНП в комплексе с MПO захватываются моноцитами/макрофагами, приводя к накоплению в них холестерина и трансформации их в пенистые клетки (4). Ингибиторы/модуляторы галогенирующей активности MПO (ЦП, ABAH и SCN-), равно как и разобщитель комплекса ЛНП-MПO (P445-456) препятствуют окислительной/галогенирующей модификации ЛНП, что, с одной стороны, уменьшает их захват клетками и снижает аккумуляцию внутриклеточного холестерина и его эфиров (5), с другой, размыкает «порочный круг» активации моноцитов (нейтрофилов) и образования модифицированных ЛНП (6) [Sokolov A.V. et al. 2014]. Данную гипотезу подтверждает факт обнаружения нами комплексов апоВ-100-содержащих липопротеинов с МПО у больных атеросклерозом [Sokolov A.V. et al. 2010].
Связывание MПO с ЛНП (1) приводит к их сайт-специфической модификации, заключающейся в повреждении главным образом белка, а также галогенирования/пероксидации липидов под действием активных форм галогенов (HOCl, HOBr), образующихся в ходе функционирования галогенирующего цикла MПO. Модифицированные ЛНП являются стимулом для лейкоцитов (2), провоцируя респираторный взрыв и экзоцитоз МПО (3) нейтрофилами и моноцитами (на рис. указано в случае моноцитов). Секретируемая MПO связывается с ЛНП (1), и, используя в качестве субстрата продуцируемый лейкоцитами Н2О2, усиливает их повреждение, замыкая тем самым «порочный круг» образования модифицированных ЛНП (1-3). Модифицированные ЛНП в комплексе с MПO захватываются моноцитами/макрофагами, приводя к накоплению в них холестерина и трансформации их в пенистые клетки (4). Ингибиторы/модуляторы галогенирующей активности MПO (ЦП, ABAH и SCN-), равно как и разобщитель комплекса ЛНП-MПO (P445-456) препятствуют окислительной/галогенирующей модификации ЛНП, что, с одной стороны, уменьшает их захват клетками и снижает аккумуляцию внутриклеточного холестерина и его эфиров (5), с другой, размыкает «порочный круг» активации моноцитов (нейтрофилов) и образования модифицированных ЛНП (6) [Sokolov A.V. et al. 2014]. Данную гипотезу подтверждает факт обнаружения нами комплексов апоВ-100-содержащих липопротеинов с МПО у больных атеросклерозом [Sokolov A.V. et al. 2010].

